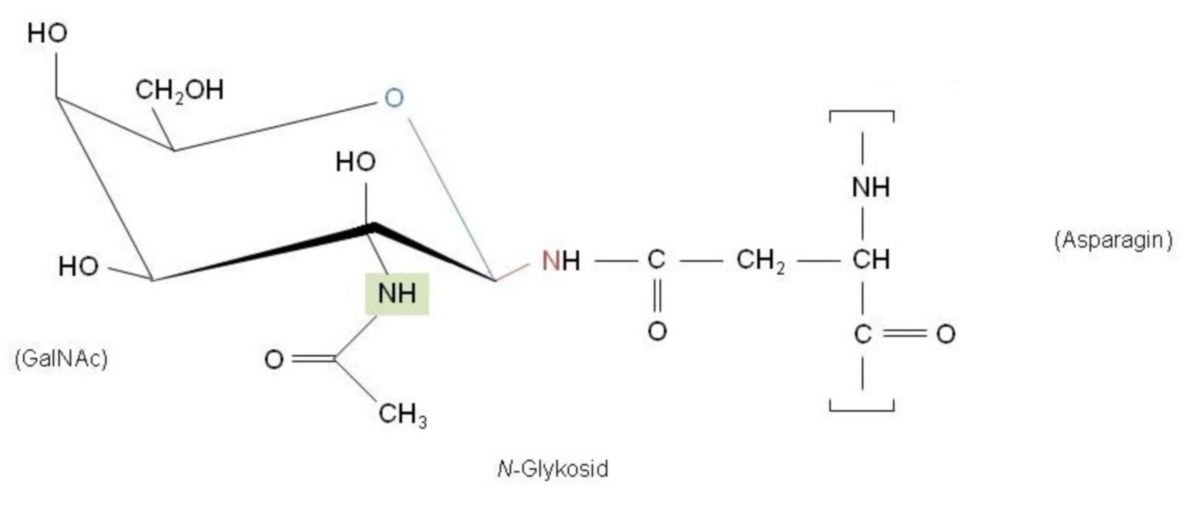
Die O-Glykosylierung (synonym O-Glycosylierung) ist eine posttranslationale Modifikation, bei der Kohlenhydrate (Glykosylgruppen) an Hydroxygruppen von Proteinen unter Ausbildung einer Etherbindung (O-) angehängt werden.
Eigenschaften
Die O-Glykosylierung ist eine Form der Glykosylierung, bei der die Glykosylgruppen mit der Seitenkette der Aminosäuren Serin oder Threonin in Proteinen kovalent verbunden werden. Sie kommt in allen Lebewesen vor. In Wirbeltieren wird die O-Glykosylierung unter anderem bei der Biosynthese von Proteoglykanen (für die extrazelluläre Matrix und Zelladhäsion), Mucinen (im Schleim) und Blutgruppenproteinen verwendet. Je nach Protein und Erkennungssequenz wird eine andere O-Glykosylierung durchgeführt. Im Gegensatz zur O-Glykosylierung wird bei der N-Glykosylierung die Glykosylgruppe auf die Aminogruppe der Seitenkette der Aminosäure Asparagin übertragen.
Biosynthese
Die Synthese der O-Glykosylierung erfolgt meist im Golgi-Apparat. Das erste Kohlenhydrat an der Hydroxygruppe eines glykosylierten Serins oder Threonins ist entweder ein N-Acetylglucosamin (GlcNAc), ein N-Acetylgalactosamin (GalNAc), eine Glucose (Glc), eine Mannose (Man), eine Fucose (Fuc) oder Xylose (Xyl).
Das Anhängen eines GlcNAc erfolgt durch die O-GlcNAc-Transferase (EC 2.4.1.255). Die Verknüpfung von GalNAc erfolgt vor allem bei Mucinen, ist die häufigste Form der O-Glykosylierung und wird durch die UDP-N-Acetyl-D-galactosamin:polypeptid N-acetylgalactosaminyltransferase (O-GalNAc-Transferase, EC 2.4.1.41) katalysiert. Mannose wird durch die Protein-O-Mannosyltransferase 1 und Protein-O-Mannosyltransferase 2 verknüpft (Mannosylierung). Fucose wird durch die GDP-Fucose Protein-O-Fucosyltransferase 1 (Fucosylierung) und Glucose wird durch die Protein-O-Glucosyltransferase an Notch gekoppelt.
Gendefekte
Gendefekte in Genen der O-Glykosylierung sind mit über 20 Krankheiten assoziiert, darunter multiple Exostosen, die progeroide Variante des Ehlers-Danlos-Syndroms, Progerie, familiäre tumorale Calcinose, Schneckenbecken-Dysplasie, Walker-Warburg-Syndrom, spondylocostale Dysostose Typ 3 und Peters-Plus-Syndrom.
Literatur
- D. Voet, J. Voet: Biochemistry, 4. Aufl., Wiley, Weinheim 2011. ISBN 978-0-470-57095-1.
- E. Staudacher: Mucin-Type O-Glycosylation in Invertebrates. In: Molecules. Band 20, Nummer 6, 2015, S. 10622–10640, doi:10.3390/molecules200610622, PMID 26065637.
- M. Goto: Protein O-glycosylation in fungi: diverse structures and multiple functions. In: Bioscience, Biotechnology, and Biochemistry. Band 71, Nummer 6, Juni 2007, S. 1415–1427, doi:10.1271/bbb.70080, PMID 17587671.
- P. H. Jensen, D. Kolarich, N. H. Packer: Mucin-type O-glycosylation–putting the pieces together. In: FEBS Journal. Band 277, Nummer 1, Januar 2010, S. 81–94, doi:10.1111/j.1742-4658.2009.07429.x, PMID 19919547.
- G. Zauner, R. P. Kozak, R. A. Gardner, D. L. Fernandes, A. M. Deelder, M. Wuhrer: Protein O-glycosylation analysis. In: Biological Chemistry. Band 393, Nummer 8, August 2012, S. 687–708, doi:10.1515/hsz-2012-0144, PMID 22944673.
Einzelnachweise